0 引言
土壤通透性是土壤重要的物理性质,不仅是影响土壤微生物活性和植物生长发育的关键因素[1-2],还是影响土壤水分运动和保持的重要属性[3]。土壤氧化还原电位(Eh)是反映土壤通气情况与氧化还原状况的指标之一,与土壤中营养物质的利用和能量转化密切相关[4],通常通气性好的土壤氧化还原电位较高[5-6]。土壤体积质量和孔隙度可以反映土壤的疏松程度,通常体积质量小的土壤较为疏松,孔隙多且透水性与通气性均较好[7]。研究发现[8],相对于传统畦灌,节水灌溉处理下土壤体积质量较小,有利于保持土壤的疏松透气;渗灌处理下土壤物理性质与漫灌存在显著差异,节水灌溉处理降低了土壤体积质量,提高了土壤总孔隙度、非毛管孔隙度和毛管孔隙度,能较好地保持土壤结构和功能[9];在淹水条件下土壤孔隙度、氧扩散率与Eh均大幅下降,说明土壤通透性受水分状况影响显著[10]。
土壤微生物不仅承担着土壤中大部分的碳、氮及其他营养物质的转化并且还促进土壤的发育[11],维持土壤功能性的同时也保证了土壤肥力的持续,在土壤生态系统中扮演着十分重要的角色[12-13]。土壤中的细菌、真菌与放线菌是土壤微生物群落结构中的主要类群,是衡量土壤质量的主要指标。土壤水分状况不仅会直接影响微生物细胞的渗透状态,还会通过改变土壤中养分的可利用性、通气性、Eh值、pH值等间接对微生物产生影响。研究表明,土壤持续湿润条件下,土壤微生物丰度与活性高于干旱条件,良好的水分条件有利于微生物群落的发展[14];土壤水分过多或过少都会严重影响微生物的数量与多样性,水分充足情况下的微生物活性与丰度高于缺水处理,同时细菌丰度在通气性好的土壤中较高[15];细菌、真菌、放线菌丰度和耗氧速率与氧化还原电位显著正相关[16];土壤微生物群落与土壤质地、种类、pH值存在极显著的相关性[17];土壤微生物生物量碳和与土壤大孔隙显著相关,增加土壤大孔隙的数量,有利于土壤微生物的活动[18];淹水使土壤溶解氧量减少,进而降低了好氧的真菌和放线菌丰度,且革兰氏阴性菌丰度与pH值正相关[19]。
传统测定土壤微生物丰度的方法是利用有选择性的培养基对微生物培养一段时间后,通过计算培养基上菌落的数量(平板计数法)从而得出微生物丰度。但由于大多数微生物在实验室条件下不可培养,培养过程中易受到培养基种类[20]、实验室的温度、pH值以及通气状况[21]等影响,因此通过这些方法测得的微生物丰度往往偏低,不到总体的1%~10%。而且,由于传统测定微生物数量的方法存在费时费力等问题,并不适合大批量的常规分析[22]。随着分子生物学的发展,PCR技术被逐渐应用于微生物群落的测定[23],相比传统方法,该技术拥有高灵敏性、高特异性、高精确度等特点[24-25]。目前,对节水灌溉条件下土壤微生物的研究主要集中在微生物活性、群落多样性与群落结构[26-28],关于不同灌溉处理下农田土壤通透性及微生物丰度影响研究鲜见。为此,以马铃薯为对象,通过设置沟灌、滴灌与喷灌对比试验,进一步了解节水灌溉条件下土壤微生物的丰度变化及其影响机制,以期为通过合理灌溉提高土壤水分利用效率、微生物活性与土壤肥力提供一定指导。
1 材料与方法
1.1 研究区概况
试验于内蒙古呼和浩特市郊马铃薯试验基地(北纬40°45′34″,东经111°41′56″)进行,该地区平均海拔1 045.4 m,属中温带大陆性季风气候。多年平均气温6.7℃,多年平均降水量335.2~534.6 mm,且主要集中在7—8月,占全年降水量的70%以上。年蒸发量2 000 mm左右,太阳辐射强,昼夜温差大,年均日照时间多于2 629.8 h,无霜期134 d。灌溉水源为地下水,水质符合灌溉水质标准。土壤类型为栗钙土,其基本理化性质见表1。
表1 土壤基本理化性质

注 不同小写字母表示处理间差异显著(p<0.05);下同。
试验于2015年5月—2016年8月进行,共设沟灌(F)、滴灌(D)、喷灌(S)3种处理,采用随机区组设计。小区规格为8 m×10 m,小区间设置1 m宽隔离带,每个处理设置3次重复。马铃薯播种时间为每年5月15日,并于当年9月15日收获。供试作物为“克新一号”脱毒原种马铃薯,每个试验小区种植8垄,每垄株距为20 cm,垄长11.2 m,垄高30 cm,垄间距90 cm。播种前施复合肥(N、P、K质量比为12∶19∶16)347 kg/hm2,1月中旬追施尿素555 kg/hm2。喷灌处理下,于马铃薯播种后灌溉1次,灌水量为389.6 m3/hm2,在马铃薯苗期根据土壤20 cm深度处土壤水基质势指导灌溉,-29.5 kPa时开始灌溉,每次喷灌97.4 m3/hm2,并于收获前10 d停止灌溉。滴灌处理与喷灌管理方式一致,播种后灌水量为198.9 m3/hm2,苗期灌水量为每次50.7 m3/hm2。沟灌生产方式同当地马铃薯生产典型灌溉管理措施相一致,每次灌水以水到垄顶为准,同样于土壤水基质势为-29.5 kPa时进行灌溉。
1.2 样品采集
于2016年8月11日采集土壤样品,该时期为马铃薯地茎形成盛期,在每个小区内按五点采样法采集根区耕层0~30 cm土壤样品。同一小区土壤样品混合均匀,去除石砾、植物残体和土壤动物,选取部分土壤-8℃保存,用于土壤微生物数量的测定。其余避光风干后,磨碎过2 mm筛,用于土壤理化性质测定。
1.3 土壤理化性质的测定
土壤氧化还原电位采用bph-221便携式Eh计测定,在每个小区内按五点法选取靠近植物根部耕层土壤,待仪器读数稳定并1 min内不再变化时,记录数据,每份样品3~4次重复。土壤体积质量采用环刀法测定[29]。土壤pH值通过pH计测定,水土质量比为2.5∶1。土壤相对密度采用比重瓶法测定。土壤有机碳采用重铬酸钾氧化-外加热法测定。土壤氨态氮采用氯化钾浸提-靛酚蓝比色法测定。土壤硝态氮采用紫外分光光度法测定。土壤总氮采用凯氏定氮仪测定。
1.4 DNA测定
1.4.1 目的基因扩增
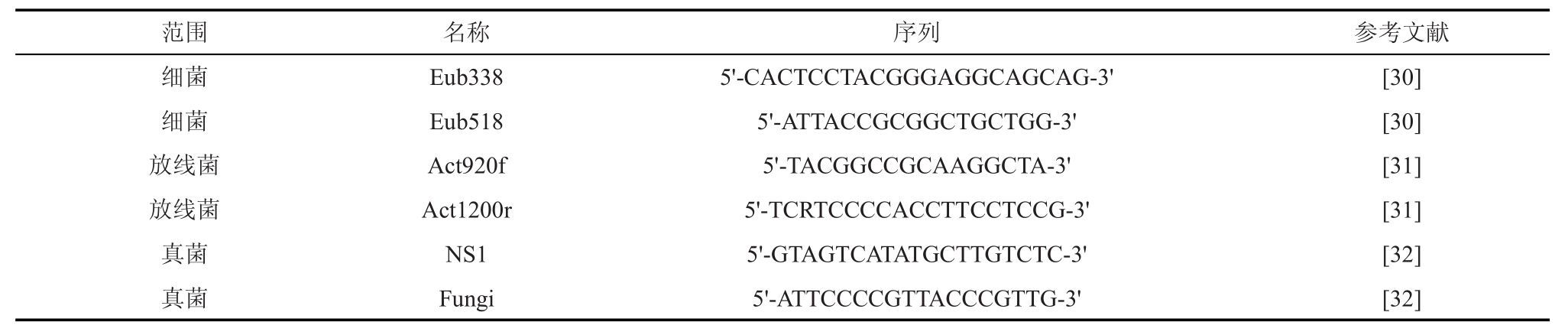
土壤DNA提取采用Fast DNA®SPIN Kit for Soil试剂盒方法(MP Biomedicals),以提纯后的土壤样品DNA为模版,选定土壤微生物系统代表性菌群通用引物进行目的基因扩增,具体引物名称和序列见表2。
表2 用于细菌、真菌、放线菌定量测定的引物
1.4.2 菌落PCR鉴定阳性克隆与质粒提取
回收的PCR产物于22℃TA连接4 h,再转入感受态细胞DH5α,37℃培养12 h。选取阳性克隆进行菌落PCR,反应完毕后,用1%琼脂糖凝胶电泳检查扩增结果,提取质粒作为绝对定量的标准品。
1.4.3 实时荧光定量PCR与标准曲线的建立
定量分析采用SYB GEEN法,反应体系为Ultra SYBR Mixture(2×)10 μL,上下游引物(10 μmol/L)各0.5 μL,模板2 μL,加灭菌蒸馏水至20 μL。扩增程序为95 ℃预变性10 min,95 ℃变性15 s,55 ℃复性30 s,72℃延伸30 s,共40个循环。将质粒标准品从104~1010进行10倍梯度稀释,每个梯度取2 μL做模板进行PCR反应,以初始模版拷贝数的对数值为横坐标,对应Ct值为纵坐标建立标准曲线,用最小二乘法算出拟合曲线。
1.5 数据处理
采用SPSS 22.0软件进行单因素方差分析(AVNOA)与相关性分析,Canoco for Windows 4.5进行去趋势对应分析(detrended correspondence analysis,DCA)和冗余分析(redundancy analysis,RDA),Origin Pro 2017软件进行制图。
2 结果与分析
2.1 不同灌溉处理对土壤通透性的影响
由图1所示,土壤Eh受灌溉方式影响显著,不同小写字母表示处理间差异显著(p<0.05),下同。沟灌、滴灌、喷灌处理下Eh分别为252.9、279.7和296.0 mV,滴灌、喷灌处理较沟灌处理分别升高了10.60%和17.04%。同时,节水灌溉显著降低了土壤体积质量,沟灌、滴灌、喷灌处理下土壤体积质量分别为1.39、1.26和1.17 g/cm3,滴灌、喷灌处理较沟灌处理分别降低了9.4%和15.8%。节水灌溉下,土壤孔隙度呈显著升高趋势,沟灌、滴灌、喷灌处理下土壤孔隙度分别为42.93、48.88和52.08 g/cm3,滴灌、喷灌处理较沟灌处理分别升高了13.9%和21.3%。
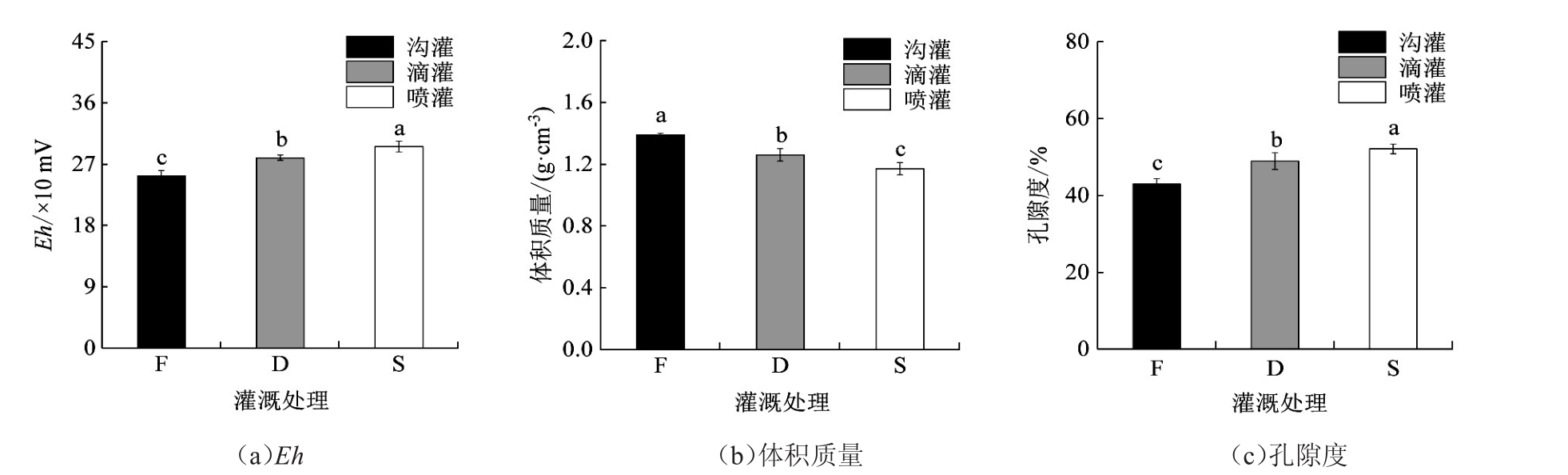
图1 不同灌溉处理下土壤Eh、体积质量和孔隙度的变化
2.2 不同灌溉处理对土壤微生物丰度的影响
如图2所示,沟灌、滴灌、喷灌处理土壤细菌丰度分别为8.24×108、9.71×108、10.77×108copies,相较于沟灌处理,滴灌和喷灌处理下细菌丰度分别增加了17.8%和30.63%。沟灌、滴灌、喷灌处理土壤真菌丰度分别为4.68×102、5.29×102、5.69×102copies,与沟灌处理相比,滴灌与喷灌处理下真菌丰度分别增加了13.09%和21.68%。喷灌处理下放线菌丰度最大,为27.11×104copies,沟灌、滴灌处理下放线菌丰度无显著差异,分别为16.98×104copies和17.63×104copies,相较于沟灌处理,滴灌与喷灌处理下放线菌丰度分别增加了3.87%和59.72%。总的来看,细菌丰度显著高于放线菌与真菌,较放线菌高出约3个数量级,较真菌高出约6个数量级。经Pearson相关性分析,3种微生物丰度之间存在极显著相关性(p<0.01)。与沟灌处理相比,节水灌溉显著提高了微生物丰度,表现为喷灌处理>滴灌处理>沟灌处理。

图2 不同灌溉处理下微生物丰度的变化
2.3 不同灌溉方式下土壤微生物丰度以及环境因子的冗余分析
利用Canoco for Windows 4.5进行去趋势对应分析(Detrended Correspondence Analysis,DCA),所得结果中最大梯度长度为0.011<3,因此,环境因子对微生物群落丰度的影响分析适宜采用冗余分析(Redundancy Aanalysis,RDA)。不同灌溉处理下土壤理化性质变化情况如表3所示。将微生物数据与土壤Eh、体积质量、孔隙度、pH值、相对密度、有机碳量、氨态氮量、硝态氮量、总氮量做RDA,排序结果显示,微生物-环境因子与前三轴的相关系数均为1,第一排序轴和第二排序轴的特征值分别为0.932和0.068,分别解释了土壤微生物的93.2%和6.8%,总排序轴即所选环境因素对物种的总解释量为100%;这说明排序轴很好地反映了微生物与环境因子间的关系。
表3 土壤理化性质变化

图3中空心箭头代表微生物变量,实心箭头代表环境变量,环境变量所处象限代表了变量与排序轴之间的相关性。由图3可知,轴1与Eh、孔隙度、有机碳和pH值正相关,相关系数分别为0.856、0.718、0.445和0.443,与土壤体积质量、氨态氮、硝态氮和相对密度负相关,相关系数分别为-0.892、-0.508、-0.361和-0.181。轴2与pH值、相对密度正相关,相关系数为0.861和0.413,与总氮、硝态氮、氨态氮、有机碳和体积质量负相关,相关系数分别为-0.971、-0.923、-0.826、-0.661和-0.422。其中Eh、孔隙度、体积质量在轴1上的投影长于其他环境因子,是影响土壤微生物丰度的主要因子。土壤有机碳、pH值、氨态氮、硝态氮所在线段在轴1投影长度较短,说明以上土壤理化指标对微生物丰度贡献低于土壤通透性。总氮、相对密度所在线段在轴1投影较其他土壤养分指标短,对微生物丰度贡献最小。根据3种灌溉处理下微生物丰度与各环境因子的Pearson相关性分析可知,土壤Eh、孔隙度、体积质量与土壤有机碳、氨态氮、硝态氮、总氮量无显著相关性。Eh、体积质量与微生物丰度均极显著相关(p<0.01),孔隙度、pH值、氨态氮、硝态氮与3种灌溉方式下细菌、真菌丰度显著相关(p<0.05)。总氮、相对密度、有机碳与微生物丰度无显著相关性。综上,有机碳、氨态氮、硝态氮、总氮量受土壤通透性影响较小,而微生物丰度受土壤通透性影响显著。土壤氨态氮、硝态氮和pH值对微生物丰度的影响小于土壤通透性,有机碳、总氮与相对密度对土壤微生物丰度无显著影响。
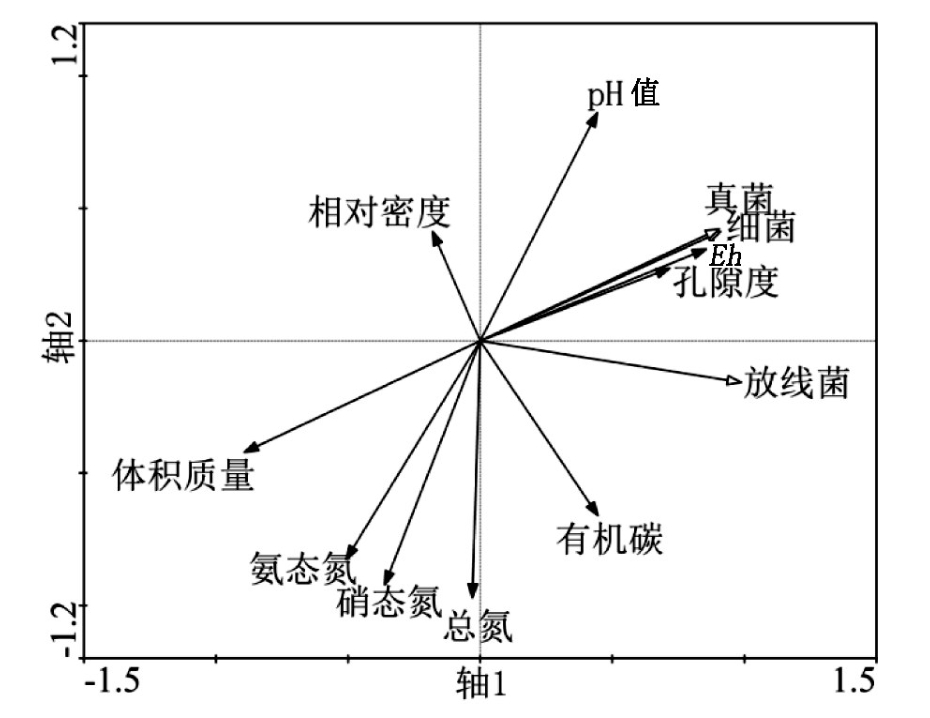
图3 不同灌溉处理下微生物丰度与环境因子RDA分析
3 讨论
灌溉作为一种主要的农田管理措施,能够改变土壤的结构和理化性质[33]。研究显示,3种灌溉处理下,喷灌处理土壤Eh、孔隙度最高,土壤体积质量最低,土壤通透性最大。滴灌处理Eh、孔隙度均低于喷灌处理,体积质量低于沟灌处理,土壤通透性低于喷灌处理,沟灌处理下土壤通透性最小。主要是由于沟灌处理下水流量大,会使土壤水较快达到饱和或过饱和状态,大量重力水对土壤团粒的浸泡和破坏会促进土体紧实而使土壤体积质量升高,孔隙度减小[34]。而节水灌溉处理下灌水强度较低,土壤孔隙水流速较慢,对土壤结构破坏程度较小,有利于土壤保持疏松和较高的通透性[33]。并且,由于滴灌处理水分主要集中在植物根部,会导致局部水分较高、土壤孔隙度小于喷灌处理。试验中土壤采集于0~30 cm耕层土壤,体积质量易受灌水、降雨和耕作等因素的影响,研究[35]发现土壤体积质量有随着种植年限的延长而增加的趋势,本研究中不同灌溉处理已进行2 a,单因素方差分析结果显示土壤体积质量受到了灌水处理的显著影响,这也进一步说明灌水方式对土壤通透性产生了显著影响。研究[5]发现,土壤Eh主要取决于土壤通气状况,土壤淹水后会使土壤孔隙氧气大量减少,加之生物活动会积累较多的二氧化碳、硫化氢、有机酸类及低价铁、锰等,使Eh降低。本研究显示在通气性较差的沟灌处理中,Eh显著低于节水灌溉处理。经相关性分析,Eh与土壤孔隙度极显著正相关而与土壤体积质量极显著负相关,说明节水灌溉有利于改善土壤通透性,进而提高土壤Eh。
土壤微生物是农田生态系统的重要组成部分,它们参与土壤有机质分解,腐殖质合成,养分转化并推动土壤的发育和形成。通常情况下,细菌约占土壤微生物总数量的70%~90%,放线菌仅次于细菌,约为5%~30%,真菌量则较少[36]。前人研究表明,土壤微生物多样性和丰度受土壤结构、水热状况及通气性的直接影响[13]。本研究显示,不同灌溉处理下土壤微生物丰度差异显著,细菌、真菌、放线菌丰度均表现为喷灌>滴灌>沟灌,微生物丰度量随土壤通透性升高而升高的趋势。RDA分析与Pearson相关性分析结果显示,微生物丰度与Eh、孔隙度、pH值显著正相关,与土壤体积质量、氨态氮、硝态氮显著负相关。研究发现,由于节水灌溉创造了土壤的好氧环境,有利于土壤微生物群落的发展,从而导致土壤中细菌、真菌、放线菌生物量的增加[37];水分差异会导致土壤理化性质的改变,通气透水性能好的土壤有利于改善微生物的繁育条件,增加土壤微生物数量[38];除土壤通气条件外,由于微生物对土壤氧化还原条件的耐受性各不相同,因此Eh变化对土壤微生物丰度、多样性和群落结构均有一定程度的影响[39];当土壤由好氧条件转为厌氧条件时,土壤Eh与微生物丰度均显著下降[40];肥力较高的土壤pH值也较高,微生物数量与土壤pH值显著正相关,较高的土壤肥力和pH值可促进土壤微生物生长活动[41];通过研究东北黑土土壤施肥状况对土壤微生物丰度的影响发现,生长季中微生物丰度与氨态氮量正相关,与硝态氮量显著负相关[42]。研究中土壤微生物丰度与氨态氮、硝态氮量均显著相关,由于前面分析已知土壤微生物丰度变化受到土壤通透性与理化指标的多重影响,进一步说明了不同灌溉处理下土壤通透性及理化指标的变化是影响土壤微生物丰度的主要因素。
4 结论
1)不同灌溉处理细菌和真菌丰度均存在显著差异,细菌、真菌、放线菌丰度均表现为喷灌>滴灌>沟灌,节水灌溉提高了土壤微生物丰度。
2)节水灌溉处理下土壤通透性发生显著变化,土壤体积质量显著下降,Eh和孔隙度显著升高,土壤的通气透水能力得到了提高。
3)土壤通透性、pH值、氨态氮与硝态氮对微生物丰度影响显著,土壤通透性、pH值高,氨态氮、硝态氮量低的土壤微生物丰度高,有机碳、总氮与相对密度对微生物丰度影响不显著。
参考文献:
[1]薛立,陈红跃,徐英宝,等.混交林地土壤物理性质与微生物数量及酶活性的研究[J].土壤通报,2004,35(2):154-158.
[2]李军,李长辉,刘喜才,等.土壤通气性对马铃薯产量的影响及其生理机制[J].作物学报,2004,30(3):279-283.
[3]高鹏,李增嘉,杨慧玲,等.渗灌与漫灌条件下果园土壤物理性质异质性及其分形特征[J].水土保持学报,2008,22(2):155-158.
[4]REDDY K R,DELAUNE R D.Biogeochemistry of wetlands[M].FL,USA:Crc Press,2008:89-119.
[5]肖梦华,胡秀君,褚琳琳.南方稻作区淹水稻田拔节期土壤微环境变化[J].节水灌溉,2015(10):30-33.
[6]刘艳,孙文涛,宫亮,等.水分调控对水稻根际土壤及产量的影响[J].灌溉排水学报,2014,33(2):98-100.
[7]郭国双.谈谈土壤容重的测定[J].灌溉排水,1983,2(2):38-42.
[8]谷丽丽,魏珉,侯加林,等.精准灌溉施肥对日光温室土壤性状及黄瓜产量品质的影响[J].中国农业科学,2015,48(22):4 507-4 516.
[9]高鹏,李增嘉,杨慧玲,等.渗灌与漫灌条件下果园土壤物理性质异质性及其分形特征[J].水土保持学报,2008,22(2):155-158.
[10]BALAKHNINA T,BENNICELLI R,STÊPNIEWSKA Z,et al.Stress responses of spring rape plants to soil flooding[J].International Agrophysics,2012,26(4):347-353.
[11]SCHULZ S,BRANKATSCHK R,DÜMIG A,et al.The role of microorganisms and plants at different stages of ecosystem development for soil forma tion[J].Biogeosciences,2013,10(6):3 983-3 996.
[12]周丽霞,丁明懋.土壤微生物学特性对土壤健康的指示作用[J].生物多样性,2007,15(2):162-171.
[13]ASADU C LA,NWAFOR I A,CHIBUIKE G U.Contributions of Microorganisms to Soil Fertility in Adjacent Forest,Fallow and Cultivated Land Use Types,in Nsukka,Nigeria[J].International Journal ofAgriculture and Forestry,2015,5(3):199-204.
[14]WILLIAMS M A,RICE C W.Seven years of enhanced water availability influences the physiological,structural,and functional attributes of a soil microbial community[J].Applied Soil Ecology,2007,35(3):535-545.
[15]冯帅,刘小利,吴小丽,等.不同水分条件对玉米根际微生物群落的影响[J].作物杂志,2017(1):127-134.
[16]何起利,梁威,贺锋,等.人工湿地氧化还原特征及其与微生物活性相关性[J].华中农业大学学报,2007,26(6):844-849.
[17]DRENOVSKY R E,STEENWERTH K L,JACKSON L E,et al.Land use and climatic factors structure regional patterns in soil microbial communities[J].Global Ecology&Biogeography,2010,19(1):27.
[18]邓超,毕利东,秦江涛,等.长期施肥下土壤性质变化及其对微生物生物量的影响[J].土壤,2013,45(5):888-893.
[19]牛佳,周小奇,蒋娜,等.若尔盖高寒湿地干湿土壤条件下微生物群落结构特征[J].生态学报,2011,31(2):474-482.
[20]TABACCHIONI S,CHIARINI L,BEVIVINO A,et al.Bias caused by using different isolation media for assessing the genetic diversity of a natural microbial population[J].Microbial Ecology,2000,40(3):169-176.
[21]TREVORS J T.Bacterial Biodiversity in Soil with an Emphasis on Chemically-Contaminated Soils[J].Water,Air&Soil Pollution,1998,101(1):45-67.
[22]TRUU M,JUHANSON J,TRUU J.Microbial biomass,activity and community composition in constructed wetlands[J].Science of the Total Environ ment,2009,407(13):3 958-3 971.
[23]TORSVIK V,ØVREåS L.Microbial diversity and function in soil:from genes to ecosystems[J].Current Opinion in Microbiology,2002,5(3):240-245.
[24]张晶,张惠文,张成刚.实时荧光定量PCR及其在微生物生态学中的应用[J].生态学报,2005,25(6):1 445-1 450.
[25]SU Yanggui,HUANG Gang,LIN Yajun,et al.No synergistic effects of water and nitrogen addition on soil microbial communities and soil respiration in a temperate desert[J].Catena,2016,142:126-133.
[26]BASTIDA F,TORRES I F,ROMERO-TRIGUEROS C,et al.Combined effects of reduced irrigation and water quality on the soil microbial communi ty of a citrus orchard under semi-arid conditions[J].Soil Biology&Biochemistry,2017,104:226-237.
[27]MOINET G Y K,CIERAAD E,HUNT J E,et al.Soil heterotrophic respiration is insensitive to changes in soil water content but related to microbial access to organic matter[J].Geoderma,2016,274:68-78.
[28]MANZONI S,SCHIMEL J P,PORPORATO A.Responses of soil microbial communities to water stress:results from a meta-analysis[J].Ecology,2012,93(4):930-938.
[29]中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1978.
[30]NAKATSU C H,TORSVIK V.Soil community analysis using DGGE of 16S rDNA polymerase chain reaction products[J].Soil Science Society of America Journal,2000,64(4):1 382-1 388.
[31]BACCHETTI D G T,ALDRED N,CLARE A S,et al.Improvement of phylum-and class-specific primers for real-time PCR quantification of bacterial taxa[J].Journal of Microbiological Methods,2011,86(3):351-356.
[32]MARSHALL M N,COCOLIN L,MILLS D A,et al.Evaluation of PCR primers for denaturing gradient gel electrophoresis analysis of fungal communi ties in compost[J].Journal ofApplied Microbiology,2003,95(5):934-948.
[33]张前兵,杨玲,孙兵,等.干旱区灌溉及施肥措施下棉田土壤的呼吸特征[J].农业工程学报,2012,28(14):77-84.
[34]柴仲平,梁智,王雪梅,等.不同灌溉方式对棉田土壤物理性质的影响[J].新疆农业大学学报,2008,31(5):57-59.
[35]蔡彦明,沃飞,方堃,等.不同种植年限蔬菜地土壤导水性能及影响因素[J].灌溉排水学报,2009,28(6):5-8.
[36]魏湜.玉米生态基础[M].北京:中国农业出版社,2010:187-188.
[37]桂娟,陈小云,刘满强,等.节水与减氮措施对稻田土壤微生物和微动物群落的影响[J].应用生态学报,2016,27(1):107-116.
[38]侯海军,张文钊,沈建林,等.水分管理对稻田细菌丰度与群落结构的影响[J].生态环境学报,2016,25(9):1 431-1 438.
[39]TRUU M,JUHANSON J,TRUU J.Microbial biomass,activity and community composition in constructed wetlands[J].Science of the Total Environment,2009,407(13):3 958-3 971.
[40]PICEK T,SIMEK M,SANTRUCKOVA H.Microbial responses to flutuation of soil aeration status and redox conditions[J].Biology&Fertility of Soils,2000,31(3/4):315-322.
[41]黎宁,李华兴,朱凤娇,等.菜园土壤微生物生态特征与土壤理化性质的关系[J].应用生态学报,2006,17(2):285-290.
[42]丁建莉,姜昕,关大伟,等.东北黑土微生物群落对长期施肥及作物的响应[J].中国农业科学,2016,49(22):4 408-4 418.
 细菌细菌放线菌放线菌真菌真菌Eub338 Eub518 Act920f Act1200r NS1 Fungi 5'-CACTCCTACGGGAGGCAGCAG-3'5'-ATTACCGCGGCTGCTGG-3'5'-TACGGCCGCAAGGCTA-3'5'-TCRTCCCCACCTTCCTCCG-3'5'-GTAGTCATATGCTTGTCTC-3'5'-ATTCCCCGTTACCCGTTG-3'[30][30][31][31][32][32]
细菌细菌放线菌放线菌真菌真菌Eub338 Eub518 Act920f Act1200r NS1 Fungi 5'-CACTCCTACGGGAGGCAGCAG-3'5'-ATTACCGCGGCTGCTGG-3'5'-TACGGCCGCAAGGCTA-3'5'-TCRTCCCCACCTTCCTCCG-3'5'-GTAGTCATATGCTTGTCTC-3'5'-ATTCCCCGTTACCCGTTG-3'[30][30][31][31][32][32]